Innovax-ILT-IBD
Konzentrat und Lösungsmittel zur Herstellung einer Injektionssuspension für Hühner
Bezeichnung des Tierarzneimittels
Innovax-ILT-IBD Konzentrat und Lösungsmittel zur Herstellung einer Injektionssuspension für Hühner
Zusammensetzung
Jede Dosis des rekonstituierten Impfstoffes (0,2 ml zur subkutanen Anwendung oder 0,05 ml zur in ovo-Anwendung) enthält:
Zellgebundenes, lebendes rekombinantes Putenherpesvirus (Stamm HVT/IBD/ILT), das das VP2-Protein des infektiösen Bursitis-Virus und die Glykoproteine gD und gI des infektiösen Laryngotracheitisvirus exprimiert: 103,2 – 104,6 PBE1.
1 PBE – Plaquebildende Einheiten.
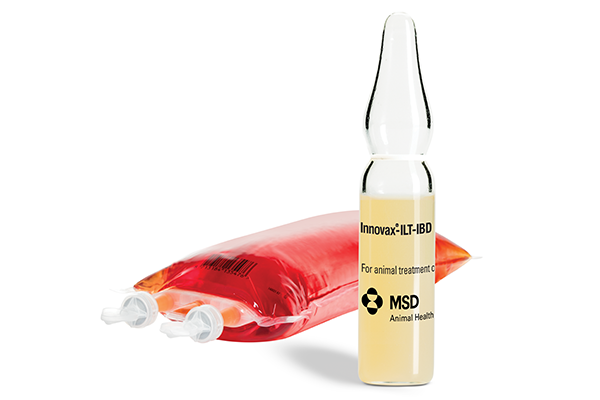
Zellkonzentrat: rötliches bis rotes Zellkonzentrat.
Lösungsmittel: klare, rote Lösung.
Zieltierart(en)
Hühner und embryonierte Hühnereier.
Anwendungsgebiet(e)
Zur aktiven Immunisierung von Eintagsküken oder 18-19 Tage alten, embryonierten Hühnereiern:
- zur Verringerung der durch eine Infektion mit aviärem infektiösen Laryngotracheitisvirus (ILT) und mit dem Virus der Marek‘schen Krankheit (MD) bedingten Mortalität, der klinischen Symptome sowie der Läsionen.
- zur Verhinderung der durch das Virus der Infektiösen Bursitis (IBD) verursachten Mortalität sowie zur Verringerung der klinischen Symptome und Läsionen.
Beginn der Immunität:
IBD: im Alter von 3 Wochen
ILT: im Alter von 4 Wochen
MD: im Alter von 5 Tagen
Dauer der Immunität:
IBD: 100 Wochen
ILT: 100 Wochen
MD: über die gesamte Risikoperiode.
Gegenanzeigen
Keine.
Besondere Warnhinweise
Besondere Warnhinweise:
Nur gesunde Tiere impfen.
Bei Hühnern mit maternalen Antikörpern kann, wenn sie mit diesem Tierarzneimittel geimpft werden, ein verzögerter Beginn der Immunität gegen IBD auftreten.
Besondere Vorsichtsmaßnahmen für die sichere Anwendung bei den Zieltierarten:
Es handelt sich hier um einen Lebendimpfstoff. Der Impfstamm kann daher von geimpften Hühnern ausgeschieden und auf Puten übertragen werden. Untersuchungen zur Verträglichkeit haben gezeigt, dass der Impfstamm für Puten unschädlich ist. Dennoch sind Vorsichtsmaßnahmen zu befolgen, um direkten oder indirekten Kontakt zwischen geimpften Hühnern und Puten zu vermeiden.
Besondere Vorsichtsmaßnahmen für den Anwender:
Der Umgang mit flüssigem Stickstoff sollte in einem gut belüfteten Bereich stattfinden.
Innovax-ILT-IBD ist eine Virussuspension, abgefüllt in Glasampullen und gelagert in flüssigem Stickstoff. Vor der Entnahme von Ampullen aus dem Behälter mit flüssigem Stickstoff sollte eine Schutzausrüstung aus Handschuhen, Kleidung mit langen Ärmeln sowie einer Gesichtsmaske und Schutzbrille getragen werden. Um schwere Verletzungen während der Entnahme einer Ampulle aus dem Behälter durch den flüssigen Stickstoff oder die Ampullen zu vermeiden, halten Sie die Handfläche der mit einem Handschuh geschützten Hand mit der Ampulle weg von Körper und Gesicht. Vorsicht walten lassen, um eine Benetzung der Hände, Augen oder Kleidung mit dem Ampulleninhalt zu vermeiden.
VORSICHT: Die Ampullen können bei plötzlichen Temperaturveränderungen zerplatzen. Nicht in heißem Wasser oder eiskaltem Wasser auftauen. Die Ampullen in sauberem Wasser bei 25 °C – 27 °C auftauen.
Besondere Vorsichtsmaßnahmen für den Umweltschutz:
Nicht zutreffend.
Legegeflügel:
Die Unbedenklichkeit des Tierarzneimittels während der Legeperiode ist nicht belegt.
Wechselwirkung mit anderen Arzneimitteln und sonstige Wechselwirkungen:
Es liegen Daten zur Unschädlichkeit und Wirksamkeit vor, die belegen, dass Innovax ILT-IBD im gleichen Lösungsmittel mit Nobilis Rismavac gemischt und in ovo oder subkutan verabreicht werden kann.
Es liegen Daten zur Unschädlichkeit und Wirksamkeit vor, die belegen, dass dieser Impfstoff am gleichen Tag aber nicht gemischt mit Nobilis ND Clone 30 oder Nobilis ND C2 oder Nobilis IB Ma5 oder Nobilis IB 4-91 an Eintagsküken verabreicht werden kann. Für eine solche zeitgleiche Anwendung wurde für ND und IB ein Beginn der Immunität von 3 Wochen belegt.
Es liegen keine Informationen zur Unschädlichkeit und Wirksamkeit des Impfstoffes bei gleichzeitiger Anwendung eines anderen Tierarzneimittels mit Ausnahme der oben genannten vor. Ob der Impfstoff vor oder nach Verabreichung eines anderen Tierarzneimittels angewendet werden sollte, muss daher von Fall zu Fall entschieden werden.
Überdosierung:
Nach Verabreichung einer 10-fachen Impfstoffdosis wurden keine unerwünschten Nebenwirkungen beobachtet.
Besondere Anwendungsbeschränkungen und besondere Anwendungsbedingungen:
Jede Person, die die Absicht hat, dieses Tierarzneimittel herzustellen, einzuführen, zu besitzen, zu verkaufen, abzugeben und/oder anzuwenden, muss sich vorher bei der zuständigen Behörde des betreffenden Mitgliedstaates über die aktuelle Impfpolitik informieren, da diese Aktivitäten entsprechend den geltenden nationalen Rechtsvorschriften im gesamten Hoheitsgebiet des Mitgliedsstaates oder in Teilen davon untersagt sein können.
Wesentliche Inkompatibilitäten:
Nicht mit anderen Tierarzneimitteln mischen, mit Ausnahme von Nobilis Rismavac und des Lösungsmittels, das zur gleichzeitigen Verwendung mit diesem Tierarzneimittel abgegeben wird.
Nebenwirkungen
Keine bekannt.
Die Meldung von Nebenwirkungen ist wichtig. Sie ermöglicht die kontinuierliche Überwachung der Verträglichkeit eines Tierarzneimittels. Falls Sie Nebenwirkungen, insbesondere solche, die nicht in der Packungsbeilage aufgeführt sind, bei Ihrem Tier feststellen, oder falls Sie vermuten, dass das Tierarzneimittel nicht gewirkt hat, teilen Sie dies bitte zuerst Ihrem Tierarzt mit. Sie können Nebenwirkungen auch an den Zulassungsinhaber unter Verwendung der Kontaktdaten am Ende dieser Packungsbeilage oder über Ihr nationales Meldesystem melden.
Dosierung für jede Tierart, Art und Dauer der Anwendung
Nach der Verdünnung eine Dosis von 0,2 ml pro Huhn mittels subkutaner Injektion in den Nacken oder eine Dosis von 0,05 ml pro Hühnerei mittels in ovo-Injektion verabreichen.
Hinweise für die richtige Anwendung
Der Beutel mit dem Impfstoff sollte während des Impfdurchganges häufig vorsichtig geschwenkt werden, um sicherzustellen, dass die Impfstoffsuspension homogen bleibt und ein korrekter Virustiter verabreicht wird (z. B. während langer Impfdurchgänge).
Zubereitung des Impfstoffes:
Die üblichen aseptischen Vorsichtsmaßnahmen sollten bei allen Vorbereitungen und Verabreichungsverfahren angewendet werden. Der Umgang mit flüssigem Stickstoff sollte in einem gut belüfteten Bereich stattfinden.
- Lösungsmittel für zellgebundene Geflügel-Impfstoffe zur Rekonstitution verwenden. Den Impfstoff gemäß der folgenden Tabellen rekonstituieren:
Zur subkutanen Anwendung den Impfstoff gemäß der folgenden Tabelle rekonstituieren:
| Lösungsmittelbeutel | Anzahl der Impfstoffampullen zur subkutanen Anwendung |
| Beutel mit 400 ml Lösungsmittel | 1 Ampulle mit 2000 Dosen |
| Beutel mit 800 ml Lösungsmittel | 2 Ampullen mit 2000 Dosen |
| Beutel mit 800 ml Lösungsmittel | 1 Ampulle mit 4000 Dosen |
| Beutel mit 1200 ml Lösungsmittel | 3 Ampullen mit 2000 Dosen |
| Beutel mit 1600 ml Lösungsmittel | 4 Ampullen mit 2000 Dosen |
| Beutel mit 1600 ml Lösungsmittel | 2 Ampullen mit 4000 Dosen |
Zur in ovo-Anwendung den Impfstoff gemäß der folgenden Tabelle rekonstituieren:
| Lösungsmittelbeutel | Anzahl der Impfstoffampullen zur in ovo Anwendung |
| Beutel mit 400 ml Lösungsmittel | 4 Ampullen mit 2000 Dosen |
| Beutel mit 400 ml Lösungsmittel | 2 Ampullen mit 4000 Dosen |
| Beutel mit 800 ml Lösungsmittel | 8 Ampullen mit 2000 Dosen |
| Beutel mit 800 ml Lösungsmittel | 4 Ampullen mit 4000 Dosen |
| Beutel mit 1200 ml Lösungsmittel | 12 Ampullen mit 2000 Dosen |
| Beutel mit 1200 ml Lösungsmittel | 6 Ampullen mit 4000 Dosen |
| Beutel mit 1600 ml Lösungsmittel | 16 Ampullen mit 2000 Dosen |
| Beutel mit 1600 ml Lösungsmittel | 8 Ampullen mit 4000 Dosen |
Das Lösungsmittel muss zum Zeitpunkt des Mischens klar und rot gefärbt, ohne Sediment und auf Raumtemperatur (15 °C – 25 °C) erwärmt sein.
- Die Zubereitung des Impfstoffes sollte geplant werden, bevor die Ampullen aus dem flüssigen Stickstoff entnommen werden, und die genaue Menge der benötigten Ampullen und des benötigten Lösungsmittels sollte vorab berechnet werden. Nach der Entnahme aus dem Ampullenhalter ist auf den Ampullen keine Information über die Anzahl der Dosen enthalten. Deshalb ist darauf zu achten, dass Ampullen mit unterschiedlichen Dosenanzahlen nicht vermischt werden und dass das richtige Lösungsmittel verwendet wird.
- Vor der Entnahme von Ampullen aus dem Behälter mit flüssigem Stickstoff die Hände mit Handschuhen schützen, Kleidung mit langen Ärmeln sowie eine Gesichtsmaske und Schutzbrille tragen. Bei der Entnahme einer Ampulle aus dem Behälter diese in der Handfläche einer mit einem Handschuh versehenen Hand weg von Körper und Gesicht halten.
- Bei Entnahme eines ganzen Ampullenhalters aus dem Behälter mit flüssigem Stickstoff nur die Ampullen entnehmen, die unmittelbar gebraucht werden. Es wird empfohlen, maximal 5 Ampullen (aus nur einem Ampullenhalter) zur gleichen Zeit zu verwenden. Nach Entnahme der Ampulle(n) sollten die verbleibenden Ampullen sofort wieder in den Behälter mit flüssigem Stickstoff gegeben werden.
- Tauen Sie den Inhalt der Ampulle(n) schnell durch Schwenken der Ampulle(n) in sauberem Wasser bei 25 °C – 27 °C auf. Die Ampulle(n) vorsichtig schütteln, um den Inhalt gleichmäßig zu mischen. Um die Zellen zu schützen, ist es wichtig, dass der Ampulleninhalt sofort nach dem Auftauen in das Lösungsmittel gemischt wird.
Die Ampulle abtrocknen, dann am Flaschenhals aufbrechen und sofort weiterverfahren wie unten beschrieben. - Den Inhalt der Ampulle vorsichtig in eine sterile Spritze mit einer 18-Gauge-Nadel aufziehen.
- Die Nadel durch den Stopfen des Lösungsmittelbeutels stechen und dann den Inhalt der Spritze vorsichtig und langsam in das Lösungsmittel geben.Den Beutel vorsichtig schwenken und drehen, um den Impfstoff zu mischen. Eine kleine Menge des Lösungmittelbeutels in die Spritze ziehen und damit die Ampulle spülen. Injizieren Sie den restlichen Inhalt der Ampulle vorsichtig in den Lösungsmittelbeutel.
- Die Schritte 6 und 7 sofern benötigt für weitere Ampullen wiederholen.
- Die Spritze entfernen und den Beutel drehen (6-8 mal), um den Impfstoff zu mischen.
- Der Impfstoff ist nun gebrauchsfertig.
Nach Zugabe des Inhalts der Ampulle zum Lösungsmittel ist das gebrauchsfertige Produkt eine klare, rot gefärbte Injektionssuspension.
Wenn dieses Tierarzneimittel mit Nobilis Rismavac gemischt wird, sollten beide im gleichen Beutel mit Lösungsmittel auf die gleiche Art verdünnt werden (400 ml Lösungsmittel für jeweils 2000 Dosen beider Tierarzneimittel oder 800 ml Lösungsmittel für jeweils 4000 Dosen beider Tierarzneimittel).
Kontrolle der korrekten Lagerung:
Um die korrekte Lagerung und den korrekten Transport der Ampullen überprüfen zu können, werden die Ampullen mit der Spitze nach unten in den Behälter mit flüssigem Stickstoff plaziert. Wenn sich in der Spitze der Ampulle gefrorener Inhalt befindet, deutet dies darauf hin, dass der Inhalt bereits aufgetaut wurde und das Produkt nicht mehr zu verwenden ist.
Wartezeiten
Null Tage.
Besondere Lagerungshinweise
Arzneimittel unzugänglich für Kinder aufbewahren.
Zellkonzentrat: In flüssigem Stickstoff (unter -140 °C) lagern und transportieren.
Lösungsmittel: Nicht über 30 °C lagern.
Stickstoffbehälter: Den Stickstoffbehälter sicher und aufrecht in einem sauberen, trockenen, gut belüfteten und von den Brut- und Kükenräumen abgetrennten Raum aufbewahren.
Sie dürfen dieses Tierarzneimittel nach dem auf dem Etikett angegebenen Verfalldatum nicht mehr anwenden. Das Verfalldatum bezieht sich auf den letzten Tag des Monats.
Haltbarkeit nach Rekonstitution gemäß den Anweisungen: 2 Stunden.
Besondere Vorsichtsmaßnahmen für die Entsorgung
Arzneimittel sollten nicht über das Abwasser oder den Haushaltsabfall entsorgt werden.
Nutzen Sie Rücknahmesysteme für die Entsorgung nicht verwendeter Tierarzneimittel oder daraus entstandener Abfälle nach den örtlichen Vorschriften und die für das betreffende Tierarzneimittel geltenden nationalen Sammelsysteme. Diese Maßnahmen dienen dem Umweltschutz.
Fragen Sie Ihren Tierarzt oder Apotheker, wie nicht mehr benötigte Arzneimittel zu entsorgen sind.
Einstufung von Tierarzneimitteln
Tierarzneimittel, das der Verschreibungspflicht unterliegt.
Zulassungsnummern und Packungsgrößen
EU/2/23/292/001-002
Eine Ampulle mit 2000 oder 4000 Dosen. Die Ampullen werden in einem Ampullenhalter aufbewahrt, an den ein farbiger Clip angeheftet ist, der die Anzahl der Dosen angibt (2000 Dosen: lachs- bis rosa-farbener Clip und 4000 Dosen: gelber Clip).
Beutel mit 400 ml Lösungsmittel, Beutel mit 800 ml Lösungsmittel, Beutel mit 1200 ml Lösungsmittel oder Beutel mit 1600 ml Lösungsmittel.
Es werden möglicherweise nicht alle Packungsgrößen in Verkehr gebracht.
Datum der letzten Überarbeitung der Packungsbeilage
04/2023
Detaillierte Angaben zu diesem Tierarzneimittel sind in der Produktdatenbank der Europäischen Union verfügbar (https://medicines.health.europa.eu/veterinary).
